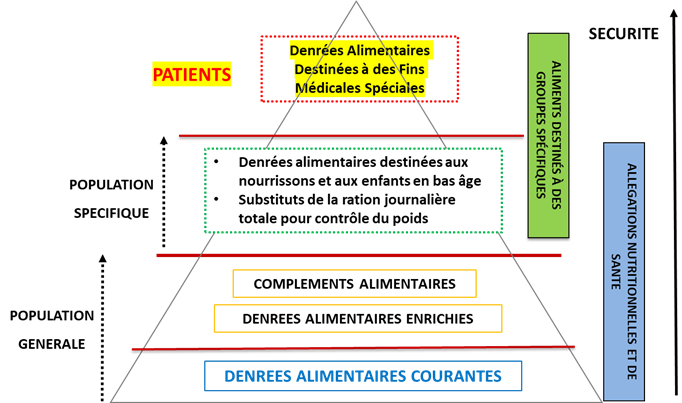
Lors de vos développements de produits de nutrition, la classification du statut du produit est l’étape indispensable pour assurer sa conformité réglementaire. Le statut réglementaire d’une denrée alimentaire dépend entre autres de la population ciblée, de sa composition et présentation et de la communication souhaitée. Le statut des Aliments pour Groupes Spécifiques (AGS) encadrés par le règlement 609/2013/UE est un statut d’intérêt lorsque l’on souhaite destiner son produit à une population spécifique.
Nous nous intéressons dans cet article à une catégorie d’AGS, les Denrées Alimentaires Destinées à des Fins Médicales Spéciales. Ces denrées sont destinées à répondre aux besoins nutritionnels particuliers de personnes atteintes de pathologies. Elles sont ainsi à la frontière entre les aliments conventionnels et les médicaments.
Définition
Auparavant appelés aliments diététiques destinés à des fins médicales spéciales (ADDFMS), ces produits sont dénommés denrées alimentaires destinées à des fins médicales spéciales (DADFMS) depuis le 22 février 2019, à la suite de l’entrée en vigueur du Règlement délégué (UE) 2016/128 du 25 septembre 2015 visant à harmoniser leur encadrement dans l’Union Européenne (UE).
Selon le Règlement (UE) N° 609/2013 du 12 juin 2013, une DADFMS est définie comme étant « une denrée alimentaire spécialement traitée ou formulée et destinée à répondre aux besoins nutritionnels de patients, y compris les nourrissons, et qui ne peut être utilisée que sous contrôle médical, et destinée à constituer l’alimentation exclusive ou partielle des patients dont les capacités d’absorption, de digestion, d’assimilation, de métabolisation ou d’excrétion des denrées alimentaires ordinaires ou de certains de leurs ingrédients ou métabolites sont diminuées, limitées ou perturbées, ou dont l’état de santé détermine d’autres exigences nutritionnelles particulières qui ne peuvent être satisfaites par une modification du seul régime alimentaire normal ».
Les DADFMS sont donc des produits de nutrition conçus pour répondre aux besoins nutritionnels particuliers de personnes atteintes de pathologies et pour lesquelles l’alimentation conventionnelle n’est pas adaptée. Elles ne répondent pas à la définition du médicament par présentation ou par fonction et sont souvent maladroitement considérées comme des compléments alimentaires, et sont aussi bien différentes des denrées alimentaires courantes ou autres aliments destinés à des groupes spécifiques.
Contrairement au médicament, les DADFMS ne possèdent pas de propriétés préventives ou curatives à l’égard de pathologies humaines. Elles peuvent être proposées dans différentes situations telles que :
- des capacités d’absorption diminuées, limitées ou perturbées (troubles de la déglutition, contexte chirurgical, déficience neurologique à la suite d’un AVC) ;
- des capacités de digestion ou d’assimilation diminuées, limitées ou perturbées (secondaire à une pathologie ou une intervention chirurgicale de l’appareil gastro-intestinal ;
- des capacités de métabolisation diminuées, limitées ou perturbées : troubles du métabolisme de certains nutriments ou maladies métaboliques héréditaires ;
- des capacités d’excrétion d’un nutriment, ou de ses métabolites, diminuées, limitées ou perturbées (pathologie rénale ou hépatique) ;
- tout autre trouble ou état de santé nécessitant une adaptation nutritionnelle (augmentation ponctuelle ou chronique des besoins en protéines ou en certains nutriments, à la suite d’une chirurgie ou dans certains cas de cancer).
Trois catégories principales
Bien qu’une définition et des exigences communes soient fixées, il existe différentes catégories de DADFMS. Elles peuvent être adaptées à une pathologie, un trouble ou un état de santé particulier ; leur voie d’administration peut varier ainsi que l’âge des patients à qui elles sont destinées :
- Les aliments complets, de composition normale : DADFMS complètes d’un point de vue nutritionnel avec une composition normale en nutriments. Elles constituent la seule source d’alimentation des personnes auxquelles elles sont destinées dès lors qu’elles sont utilisées conformément aux instructions de leur fabricant.
Exemple : Les denrées alimentaires répondant aux besoins nutritionnels en cas de dénutrition associée à une maladie chez des patients requérant une nutrition entérale.
- Les aliments complets, de composition adaptée : DADFMS complètes d’un point de vue nutritionnel avec une composition adaptée. Elles constituent la seule source d’alimentation des personnes auxquelles elles sont destinées dès lors qu’elles sont utilisées conformément aux instructions de leur fabricant.
Exemple : Les laits infantiles adaptés aux besoins nutritionnels du nourrisson de 6 à 12 mois, en cas d’allergie aux protéines de lait de vache et / ou d’intolérance au lactose.
- Les aliments incomplets, de composition normale ou adaptée : DADFMS incomplètes d’un point de vue nutritionnel qui peuvent avoir une composition normale ou adaptée aux besoins nutritionnels propres à une maladie, à un trouble ou à un état de santé particulier. Ces DADFMS ne peuvent pas constituer la seule source d’alimentation.
Exemple : Les denrées alimentaires consommées dans le cadre d’une dénutrition chez les patients cancéreux, d’une dysphagie ou de diarrhée.
Réglementation en vigueur
En termes de composition et d’étiquetage, les DADFMS sont régies par le Règlement (UE) N° 609/2013 et le Règlement délégué (UE) 2016/128 en ce qui concerne les exigences spécifiques en matière de composition et d’information applicables aux denrées alimentaires destinées à des fins médicales spéciales. Ce dernier Règlement est applicable (à la place de la Directive européenne 1999/21/CE) depuis le 22 février 2019 pour les DADFMS destinées aux besoins nutritionnels de personnes autres que nourrissons et depuis le 22 février 2020 pour les DADFMS destinées aux nourrissons (comme la plupart des dispositions du Règlement délégué (UE) 2016/127 concernant les préparations pour nourrissons et de suite).
Mise sur le marché
Les DADFMS doivent être notifiés au niveau national et les autorités compétentes peuvent demander à tout moment un dossier scientifique justifiant que le produit répond aux besoins particuliers de la population ciblée. Les DADFMS peuvent aussi faire l’objet d’un remboursement selon certaines conditions établies par la Haute Autorité de Santé (HAS).
Les DADFMS doivent être vendues préemballées, prêtes à l’emploi ou à reconstituer. Elles peuvent être consommées par voie orale ou administrées par voie entérale. Leur utilisation, sous contrôle médical assurée par des professionnels de santé compétents dans le domaine de la diététique et de la nutrition, selon les recommandations décrites par leur fabricant est sûre, adaptée et efficace pour les personnes à qui elles sont destinées.
Les consultants experts dans la réglementation des Aliments pour Groupes Spécifiques vous accompagnent pour la mise sur le marché de vos produits en Europe :
- Conformité de vos produits (composition, étiquetage)
- Rédaction des dossiers scientifiques
- Réalisation des déclarations auprès des autorités compétentes
#RNINews #DADFMS